Creado por: Melany Torres Osma.
Grado: 11.2
Utilidad de los alcoholes, éteres
& esteres en la industria.
ALCOHOLES.
Los alcoholes primarios y secundarios son líquidos incoloros y de olor agradable, solubles en el agua en cualquier proporción y menos densos que ella. Los terciarios en cambio son todos sólidos. Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como solventes y combustibles. El etanol y el metanol pueden hacerse combustir de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como solvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
PROPIEDADES
- Propiedades físicas.
Las propiedades físicas de un alcohol se basan específicamente en su estructura. el alcohol está compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo -OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que modifica, dependiendo de su tamaño y forma.
- Propiedades químicas.
Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto que ejerce la molécula de -OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo.
USOS
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
- El alcohol metílico (metanol), también denominado carbinol, alcohol de madera alcohol de quemar, etc, es el término mas sencillo de los alcoholes. Es un liquido incoloro de escasa viscosidad y de olor y sabor penetrante, inmiscible (que no se puede mezclar) con el agua y con la mayoría de los disolventes orgánicos, siendo además muy tóxico e inflamable.
- El alcohol etílico, se obtiene por síntesis del etileno o por dermentacion de las melazas o almidón. Estos a su vez es extraído de determinados productos hortofrutícolas con alto contenido de azúcar, siendo la remolacha el más común. Este es el utilizado en la sanidad y en aquellos elaborados para el consumo humano.
BENEFICIOS PARA LA SALUD
- Permite sustituir un combustible fósil e importado por uno renovable y producido localmente.
- Conlleva a un incremento en la generación de energía a partir de biomasa.
- Es una tecnología probada.
RIESGOS PARA LA SALUD.
- Metanol
se produce mediante la oxidación directa de hidrocarburos o mediante un proceso de hidrogenación en dos etapas en el que se hidrogena el monóxido de carbono para dar formiato de metilo, que a su vez se hidrogena para obtener alcohol metílico. Sin embargo, la síntesis más importante es la realizada mediante hidrogenación catalítica a presión del monóxido de carbono o del dióxido de carbono, a presiones de 100-600 kgf/cm2 y temperaturas de 250-400 ºC.
El alcohol metílico tiene propiedades tóxicas que pueden hacerse evidentes tanto por exposición aguda como crónica. Los alcohólicos que ingieren este líquido o los trabajadores que inhalan sus vapores pueden sufrir lesiones. En experimentos con
animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal.
- n-Propanol
No se han notificado casos de intoxicación relacionados con el uso industrial de n-propanol. Para los animales de experimentación es moderadamente tóxico cuando se administra por vías respiratoria, oral o percutánea. Irrita las mucosas y deprime el sistema nervioso central. Cuando se inhala, produce una leve irritación del aparato respiratorio y ataxia. Es algo más tóxico que el alcohol isopropílico, pero aparentemente provoca los mismos efectos biológicos. Se conoce un caso de fallecimiento por ingestión de 400 ml de n-propanol. Los cambios morfopatológicos observados fueron principalmente edema cerebral y pulmonar, también presentes con frecuencia en la intoxicación etílica. El n-propanol es inflamable y representa un riesgo moderado de incendio.
- Etanol
Un riesgo industrial frecuente es la exposición a vapores en la proximidad de un proceso en el que se utiliza alcohol etílico. La exposición prolongada a concentraciones superiores a 5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor, fatiga y narcosis. El alcohol etílico se oxida muy rápidamente en el organismo a dióxido de carbono y agua. El alcohol no oxidado
se excreta en la orina y en el aire espirado, de manera que apenas se producen efectos acumulativos. Su efecto en la piel es similar al de todos los disolventes de grasas y, de no tomarse las debidas precauciones, puede producirse una dermatitis de contacto.
Recientemente se ha sospechado la existencia de otro riesgo potencial en las personas expuestas a etanol sintético, por haberse demostrado que este producto es cancerígeno en ratones tratados con dosis altas. Un estudio epidemiológico posterior ha revelado una mayor incidencia de cáncer de laringe (cinco veces superior a la prevista) en un grupo de trabajadores empleados en una fábrica de etanol obtenido mediante ácidos fuertes. Parece ser que el agente causal fue el sulfato de dietilo, aunque también estaban implicados las alquil sulfonas y otros posibles cancerígenos
NOMBRE Y ESTRUCTURA QUÍMICA DE LOS COMPUESTOS MÁS REPRESENTATIVOS.
Nombre
Fórmula
2-Hexanol (Hexan-2-ol)
CH3-CH-OH-CH2-CH2-CH2-CH3
4-Metil-2-pentanol
CH3-CH-OH-CH2-CH-(CH3)-CH3
3-Etil-1,4-hexanodiol
CH2-OH-CH2-CH-(CH2-CH3)-CH-OH-CH2-CH3
3-Penten-1-ol (Pent-3-en-1-ol)
CH2-OH-CH2-CH-CH-CH3
2,4-Pentanodiol
(Pentano-2,4-diol)
CH3-CH-OH-CH2-CH-OH-CH3
- Propiedades químicas.
USOS
- El alcohol metílico (metanol), también denominado carbinol, alcohol de madera alcohol de quemar, etc, es el término mas sencillo de los alcoholes. Es un liquido incoloro de escasa viscosidad y de olor y sabor penetrante, inmiscible (que no se puede mezclar) con el agua y con la mayoría de los disolventes orgánicos, siendo además muy tóxico e inflamable.
- El alcohol etílico, se obtiene por síntesis del etileno o por dermentacion de las melazas o almidón. Estos a su vez es extraído de determinados productos hortofrutícolas con alto contenido de azúcar, siendo la remolacha el más común. Este es el utilizado en la sanidad y en aquellos elaborados para el consumo humano.
- Permite sustituir un combustible fósil e importado por uno renovable y producido localmente.
- Conlleva a un incremento en la generación de energía a partir de biomasa.
- Es una tecnología probada.
RIESGOS PARA LA SALUD.
- Metanol
se produce mediante la oxidación directa de hidrocarburos o mediante un proceso de hidrogenación en dos etapas en el que se hidrogena el monóxido de carbono para dar formiato de metilo, que a su vez se hidrogena para obtener alcohol metílico. Sin embargo, la síntesis más importante es la realizada mediante hidrogenación catalítica a presión del monóxido de carbono o del dióxido de carbono, a presiones de 100-600 kgf/cm2 y temperaturas de 250-400 ºC.
El alcohol metílico tiene propiedades tóxicas que pueden hacerse evidentes tanto por exposición aguda como crónica. Los alcohólicos que ingieren este líquido o los trabajadores que inhalan sus vapores pueden sufrir lesiones. En experimentos con
animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal.
- n-Propanol
No se han notificado casos de intoxicación relacionados con el uso industrial de n-propanol. Para los animales de experimentación es moderadamente tóxico cuando se administra por vías respiratoria, oral o percutánea. Irrita las mucosas y deprime el sistema nervioso central. Cuando se inhala, produce una leve irritación del aparato respiratorio y ataxia. Es algo más tóxico que el alcohol isopropílico, pero aparentemente provoca los mismos efectos biológicos. Se conoce un caso de fallecimiento por ingestión de 400 ml de n-propanol. Los cambios morfopatológicos observados fueron principalmente edema cerebral y pulmonar, también presentes con frecuencia en la intoxicación etílica. El n-propanol es inflamable y representa un riesgo moderado de incendio.
- Etanol
Un riesgo industrial frecuente es la exposición a vapores en la proximidad de un proceso en el que se utiliza alcohol etílico. La exposición prolongada a concentraciones superiores a 5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor, fatiga y narcosis. El alcohol etílico se oxida muy rápidamente en el organismo a dióxido de carbono y agua. El alcohol no oxidado
se excreta en la orina y en el aire espirado, de manera que apenas se producen efectos acumulativos. Su efecto en la piel es similar al de todos los disolventes de grasas y, de no tomarse las debidas precauciones, puede producirse una dermatitis de contacto.
Recientemente se ha sospechado la existencia de otro riesgo potencial en las personas expuestas a etanol sintético, por haberse demostrado que este producto es cancerígeno en ratones tratados con dosis altas. Un estudio epidemiológico posterior ha revelado una mayor incidencia de cáncer de laringe (cinco veces superior a la prevista) en un grupo de trabajadores empleados en una fábrica de etanol obtenido mediante ácidos fuertes. Parece ser que el agente causal fue el sulfato de dietilo, aunque también estaban implicados las alquil sulfonas y otros posibles cancerígenos
| Nombre | Fórmula |
| 2-Hexanol (Hexan-2-ol) | CH3-CH-OH-CH2-CH2-CH2-CH3 |
| 4-Metil-2-pentanol | CH3-CH-OH-CH2-CH-(CH3)-CH3 |
| 3-Etil-1,4-hexanodiol | CH2-OH-CH2-CH-(CH2-CH3)-CH-OH-CH2-CH3 |
| 3-Penten-1-ol (Pent-3-en-1-ol) | CH2-OH-CH2-CH-CH-CH3 |
| 2,4-Pentanodiol (Pentano-2,4-diol) | CH3-CH-OH-CH2-CH-OH-CH3 |
DESTILACIÓN DE ALCOHOLES.
La deshidratación de alcoholes es el proceso químico que consiste en la transformación de un alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar.
Por esto, la deshidratación de alcoholes es útil, puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua. Se reemplaza el grupo hidroxilo por una halógeno en la reacción de appel.
Halogenación de alcoholes
Para clorar o bromar alcoholes, se deben tomar en cuenta las siguientes consideraciones:
- Alcohol primario: los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ion cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
- Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
- Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
Los alcoholes terciarios reaccionan con ácido clorhídrico directamente para producir el cloroalcano terciario, pero si se usa un alcohol primario o secundario es necesaria la presencia de un ácido de lewis, un "activador", como el cloruro de zinc. Como alternativa la conversión puede ser llevada a cabo directamente usando cloruro de tionilo (SOCl2). Un alcohol puede también ser convertido a bromoalcano usando ácido bromhídrico o tribromuro de fósforo (PBr3), o a yodoalcano usando fósforo rojo y yodo para generar "in situ" el triyoduro de fósforo. Dos ejemplos:
- (H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
- CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
ÉTERES.
Es un producto líquido a temperatura ambiente, muy volátil y
extremadamente inflamable. Es incoloro de olor púrguenle dulce. Se usa como
medio de reacción, disolvente, agente extractivo y anestésico general.
- (H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
- CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
PROPIEDADES
- PROPIEDADES QUÍMICAS.
El éter metílico (P.e. -24°C) y el éter metil etílico (P.e. 8°C) son gases a temperatura normal. Ya el éter etílico (P.e. 35°C) es un líquido muy volátil. Los éteres con cadenas carbonadas mayores van teniendo mayor punto de ebullición a medida que aumenta la longitud de la cadena.
- PROPIEDADES FÍSICAS.
Los éteres de cadena recta tiene un punto de ebullición bastante similar a los alcanos. Son los responsables del aroma. de las rosas, frutas y todo lo tenga olor en la materia orgánica nos sirven para identificar los olores.
La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxigeno, que posee dos pares de electrones no compartidos. No puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles. Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclopropano.
USOS
- Medio para extractar para concentrar el acido acético y otros ácidos.
- Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
- Disolvente de sustancias orgánicas (aceites, grasas resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores diésel.
- Fuertes pegamentos.
NOMBRE Y ESTRUCTURA QUÍMICA.
Nombre
Fórmula
Metoxietano (Etil metil éter)

Dietiléter (Etoxietano)

Etil fenil éter (Etoxibenceno)

Reacciones
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante un nucleófilo.
-
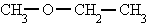
metoxietano
etil metil éter 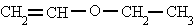
etoxieteno
etenil etil éter
etil vinil éter 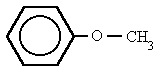
metoxibenceno
fenil metil éter
IMPORTANCIA Y NOMENCLATURA
- OBJETIVO GENERAL
Mostrar la importancia de estos compuestos en la industria y cuáles son los
pasos que se deben seguir para nombrarlos .
- OBJETIVOS ESPECÍFICOS
-conocer los compuestos orgánicos llamados Éteres
- Identificar sus propiedades físicas y químicas
- aplicar la nomenclatura de estos compuestos orgánicos para aprenderlos a
nombrar.
Fuentes y usos del
éter
Los éteres de forma compleja son muy abundantes en la vida vegetal formando
parte de las resinas de las plantas, colorantes de flores y otros.
El éter etílico (o simplemente éter), se obtiene estéticamente y es un
depresor del sistema nervioso central, por este motivo ha sido utilizado como
anestésico. Probablemente el éter sea la sustancia mas utilizada en el laboratorio para los
procesos de extracción con solvente, aun siendo potencialmente peligroso por su
inflamabilidad y volatilidad.
CARACTERÍSTICAS INDUSTRIALES
Es un producto líquido a temperatura ambiente, muy volátil y extremadamente
inflamable. Es incoloro de olor dulce. Se usa como medio de reacción,
disolvente, agente extractivo y anestésico general USOS El éter de mayor
importancia comercial es el dietil éter al que con frecuencia se le llama éter
etílico o simplemente éter. El éter es un buen solvente para reacciones y
extracciones además con frecuencia se utiliza como un fluido volátil para
arranque de motores diésel y a gasolina.
El éter se empleó como anestésico quirúrgico durante 100 años (desde 1842),
pero es muy inflamable y con frecuencia los pacientes vomitaban al despertar de
la anestesia.
Actualmente se emplean varios compuestos que son menos inflamables y se toleran
con mayor facilidad como el óxido nitroso (N2O).
IMPORTANCIA DEL ÉTER
Son compuestos
que resultan de la unión de dos radicales alquílicos o aromáticos a través de
un puente de oxígeno -O-.son compuestos que tienen un átomo de oxígeno unido a
dos radicales hidrocarburos. Al igual que los ésteres, no forman puentes de hidrógeno. Presentan una alta
hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser
utilizados como disolventes orgánicos. Éter Nomenclatura Los éteres pueden
nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC sustitutiva). Se
toma como cadena principal la de mayor longitud y se nombra el alcóxido como un
sustituyente. Regla 2. La nomenclatura funcional (IUPAC) nombra los
éteres como derivados de dos grupos alquilo, ordenados alfabéticamente,
terminando el nombre en la palabra éter.
APLICACIÓN EN LA INDUSTRIA
Se utiliza
como disolvente en la fabricación de explosivos y en medina como
antiespasmódico. Anteriormente se empleaba como anestésico, pero debido a que es muy inflamable
y a los efectos secundarios, ha sido reemplazado por otras sustancias.
ESTERES
Los Esteres son compuestos que se forman por la unión de ácidos con alcoholes, generando agua como subproducto.
Como se ve en el ejemplo, el hidroxilo del ácido se combina con el hidrógeno del radical hidroxilo del alcohol.
PROPIEDADES
- Propiedades físicas:
Los que son de bajo peso molecular son líquidos volátiles de olor agradable. Son las responsables de los olores de ciertas frutas. Los ésteres superiores son sólidos cristalinos, inodoros. Solubles en solventes orgánicos e insolubles en agua. Son menos densos que el agua.
- Propiedades Químicas:
- Hidrólisis ácida:
Ante el calor, se descomponen regenerando el alcohol y el ácido correspondiente. Se usa un exceso de agua para inclinar esta vez la reacción hacia la derecha. Como se menciono es la inversa de la esterificación.
-Hidrólisis en medio alcalino:
En este caso se usan hidróxidos fuertes para atacar al éster, y de esta manera regenerar el alcohol. Y se forma la sal del ácido orgánico.
USOS Y APLICACIONES
- La mejor aplicación es utilizarlo en esencias para dulces y bebidas. Otros para preparar perfumes. Otros como antisépticos, como el cloruro de etilo
- Los esteres son compuestos líquidos y sólidos que poseen olores agradables, los cuales se encuentran distribuidos ampliamente en la naturaleza en flores y frutas.
- metano de metilo o formiato de metilo (HCOOCH3) : olor a ron.
- el solicilato de metilo se emplea principalmente como agente aromizante y posee la ventaja de que se absorbe atravez de la piel.
Nomenclatura
Se nombran como si fuera una sal, con la terminación “ato” luego del nombre del ácido seguido por el nombre del radical alcohólico con el que reacciona dicho ácido.
Los ésteres se pueden clasificar en dos tipos:
- Ésteres inorgánicos
Son los que derivan de un alcohol y de un ácido inorgánico. Por ejemplo:
- Ésteres orgánicos
Son los que tienen un alcohol y un ácido orgánico. Como ejemplo basta ver el etanoato de propilo expuesto arriba. Otro criterio o forma de clasificarlos es según el tipo de ácido orgánico que se uso en su formación. Es decir, si se trata de un ácido alifático o aromático. Aromáticos son los derivados de los anillos bencénicos como se ha explicado anteriormente. Para los alifáticos hacemos alusión nuevamente al etanoato de propilo anteriormente expuesto.
Al proceso de formación de un éster a partir de un ácido y un alcohol se lo denomina esterificación. Pero al proceso inverso, o sea, a la hidrólisis del éster para regenerar nuevamente el ácido y el alcohol se lo nombra saponificación. Este término como veremos es también usado para explicar la obtención de jabones a partir de las grasas.
Obtención de Ésteres
Los ésteres se preparan combinando un ácido orgánico con un alcohol. Se utiliza ácido sulfúrico como agente deshidratante. Esto sirve para ir eliminando el agua que se forma y de esta manera hacer que la reacción tienda su equilibrio hacia la derecha, es decir, hacia la formación del éster.
BIBLIOGRAFIA
- http://www.slideshared.net/jachipe/esteres-presentacion1
- www.alcohol.com
- http://www.facmed.unam.mx/deptos/salud/censenanza/spivst/2012/104-03.pdf
- www.imagenesdealcoholes.com
- www.esteres.com.pfcjsl.
- www.eteres.com
- diccionario enciclopedia
- diccionario el mundo
- www.diapositivasdeesteres.com
Nombre
|
Fórmula
|
Metoxietano (Etil metil éter)
| |
Dietiléter (Etoxietano)
| |
Etil fenil éter (Etoxibenceno)
|  |
Reacciones
metoxietano
etil metil éter | |
etoxieteno
etenil etil éter
etil vinil éter | |
 |
metoxibenceno
fenil metil éter |
IMPORTANCIA Y NOMENCLATURA
- OBJETIVO GENERAL
- OBJETIVOS ESPECÍFICOS
-conocer los compuestos orgánicos llamados Éteres
- Identificar sus propiedades físicas y químicas
- aplicar la nomenclatura de estos compuestos orgánicos para aprenderlos a nombrar.
- Identificar sus propiedades físicas y químicas
- aplicar la nomenclatura de estos compuestos orgánicos para aprenderlos a nombrar.
Fuentes y usos del
éter
Los éteres de forma compleja son muy abundantes en la vida vegetal formando
parte de las resinas de las plantas, colorantes de flores y otros.
El éter etílico (o simplemente éter), se obtiene estéticamente y es un depresor del sistema nervioso central, por este motivo ha sido utilizado como anestésico. Probablemente el éter sea la sustancia mas utilizada en el laboratorio para los procesos de extracción con solvente, aun siendo potencialmente peligroso por su inflamabilidad y volatilidad.
El éter etílico (o simplemente éter), se obtiene estéticamente y es un depresor del sistema nervioso central, por este motivo ha sido utilizado como anestésico. Probablemente el éter sea la sustancia mas utilizada en el laboratorio para los procesos de extracción con solvente, aun siendo potencialmente peligroso por su inflamabilidad y volatilidad.
CARACTERÍSTICAS INDUSTRIALES
Es un producto líquido a temperatura ambiente, muy volátil y extremadamente inflamable. Es incoloro de olor dulce. Se usa como medio de reacción, disolvente, agente extractivo y anestésico general USOS El éter de mayor importancia comercial es el dietil éter al que con frecuencia se le llama éter etílico o simplemente éter. El éter es un buen solvente para reacciones y extracciones además con frecuencia se utiliza como un fluido volátil para arranque de motores diésel y a gasolina.
El éter se empleó como anestésico quirúrgico durante 100 años (desde 1842), pero es muy inflamable y con frecuencia los pacientes vomitaban al despertar de la anestesia. Actualmente se emplean varios compuestos que son menos inflamables y se toleran con mayor facilidad como el óxido nitroso (N2O).
IMPORTANCIA DEL ÉTER
Son compuestos
que resultan de la unión de dos radicales alquílicos o aromáticos a través de
un puente de oxígeno -O-.son compuestos que tienen un átomo de oxígeno unido a
dos radicales hidrocarburos. Al igual que los ésteres, no forman puentes de hidrógeno. Presentan una alta
hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser
utilizados como disolventes orgánicos. Éter Nomenclatura Los éteres pueden
nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC sustitutiva). Se
toma como cadena principal la de mayor longitud y se nombra el alcóxido como un
sustituyente. Regla 2. La nomenclatura funcional (IUPAC) nombra los
éteres como derivados de dos grupos alquilo, ordenados alfabéticamente,
terminando el nombre en la palabra éter.
APLICACIÓN EN LA INDUSTRIA
Se utiliza
como disolvente en la fabricación de explosivos y en medina como
antiespasmódico. Anteriormente se empleaba como anestésico, pero debido a que es muy inflamable
y a los efectos secundarios, ha sido reemplazado por otras sustancias.
ESTERES
Los Esteres son compuestos que se forman por la unión de ácidos con alcoholes, generando agua como subproducto.
Como se ve en el ejemplo, el hidroxilo del ácido se combina con el hidrógeno del radical hidroxilo del alcohol.
PROPIEDADES
- Propiedades físicas:
Los que son de bajo peso molecular son líquidos volátiles de olor agradable. Son las responsables de los olores de ciertas frutas. Los ésteres superiores son sólidos cristalinos, inodoros. Solubles en solventes orgánicos e insolubles en agua. Son menos densos que el agua.
- Propiedades Químicas:
- Hidrólisis ácida:
Ante el calor, se descomponen regenerando el alcohol y el ácido correspondiente. Se usa un exceso de agua para inclinar esta vez la reacción hacia la derecha. Como se menciono es la inversa de la esterificación.
-Hidrólisis en medio alcalino:
En este caso se usan hidróxidos fuertes para atacar al éster, y de esta manera regenerar el alcohol. Y se forma la sal del ácido orgánico.
USOS Y APLICACIONES
- La mejor aplicación es utilizarlo en esencias para dulces y bebidas. Otros para preparar perfumes. Otros como antisépticos, como el cloruro de etilo
- Los esteres son compuestos líquidos y sólidos que poseen olores agradables, los cuales se encuentran distribuidos ampliamente en la naturaleza en flores y frutas.
- metano de metilo o formiato de metilo (HCOOCH3) : olor a ron.
- el solicilato de metilo se emplea principalmente como agente aromizante y posee la ventaja de que se absorbe atravez de la piel.
Nomenclatura
Se nombran como si fuera una sal, con la terminación “ato” luego del nombre del ácido seguido por el nombre del radical alcohólico con el que reacciona dicho ácido.
Los ésteres se pueden clasificar en dos tipos:
- Ésteres inorgánicos
Son los que derivan de un alcohol y de un ácido inorgánico. Por ejemplo:
- Ésteres orgánicos
Son los que tienen un alcohol y un ácido orgánico. Como ejemplo basta ver el etanoato de propilo expuesto arriba. Otro criterio o forma de clasificarlos es según el tipo de ácido orgánico que se uso en su formación. Es decir, si se trata de un ácido alifático o aromático. Aromáticos son los derivados de los anillos bencénicos como se ha explicado anteriormente. Para los alifáticos hacemos alusión nuevamente al etanoato de propilo anteriormente expuesto.
Al proceso de formación de un éster a partir de un ácido y un alcohol se lo denomina esterificación. Pero al proceso inverso, o sea, a la hidrólisis del éster para regenerar nuevamente el ácido y el alcohol se lo nombra saponificación. Este término como veremos es también usado para explicar la obtención de jabones a partir de las grasas.
Obtención de Ésteres
Los ésteres se preparan combinando un ácido orgánico con un alcohol. Se utiliza ácido sulfúrico como agente deshidratante. Esto sirve para ir eliminando el agua que se forma y de esta manera hacer que la reacción tienda su equilibrio hacia la derecha, es decir, hacia la formación del éster.
- http://www.slideshared.net/jachipe/esteres-presentacion1
- www.alcohol.com
- http://www.facmed.unam.mx/deptos/salud/censenanza/spivst/2012/104-03.pdf
- www.imagenesdealcoholes.com
- www.esteres.com.pfcjsl.
- www.eteres.com
- diccionario enciclopedia
- diccionario el mundo
- www.diapositivasdeesteres.com






















.jpg)
.png)
